当社の事業の状況、経理の状況等に関する事項のうち、投資者の判断に重要な影響を与える可能性のあるリスク要因には、以下のようなものがあります。
当社は、これらのリスク発生の可能性を認識した上で発生の回避及び発生した場合の対応に努める方針でありますが、本株式に関する投資判断は本項及び本項以外の記載事項を慎重に検討した上で行われる必要があると考えられます。
なお、文中の将来に関する事項は、別段の表示がない限り、本書提出日時点において、当社が判断したものであります。
創薬事業における研究開発について
(1) 事業の内容について
① 研究開発投資が高額であることにかかる事項
当社が行う医薬品及び検査薬の研究開発は、その期間が長期にわたり、コストも高額であります。
当社は、保有するパイプラインにおいて初期の臨床試験までの開発を効率的に進めることに注力し、そこで得られた有効性と安全性のデータを以って製薬企業へのライセンス契約締結を実現することを基本的な事業活動と位置付けています。また、政府など各種の補助金を利用して経費を下げるとともに、ライセンス契約締結後の後期臨床試験以降の開発費用はライセンス先の拠出となることで、当社が負担する開発コストを最小限に抑えるとともに、契約一時金収入及びマイルストーン収入を確保することで、新規パイプラインへの再投資が実現することを事業サイクルとしております。
しかしながら、万一、ライセンス契約締結及び維持に支障が発生した場合は、当社の事業収入が減少し、新規パイプライン開発への再投資が困難になる可能性があります。また、ライセンス対象となるパイプラインの開発費用をライセンス先が負担しないため、当社に発生する多大な研究開発費負担が当社業績を圧迫し、結果として開発の大幅な遅れや開発中止といった事態に及んだ場合、当社の事業、財務状況及び業績に影響を与える可能性があります。
② パイプラインの安全性及び有効性にかかる事項
当社が開発する医薬品及び検査薬のパイプラインにおいて、安全性や有効性の評価に問題が発見された場合は、開発が大幅に遅れる可能性もしくは開発そのものを中止する可能性があります。
当社は、保有するパイプラインの安全性及び有効性の評価を確実なものとするために、
ⅰ) 科学評価顧問等のネットワークを最大限活用したパイプライン価値の適正な評価
ⅱ) 非臨床・前臨床段階における徹底的な安全性及び有効性の検証
ⅲ) PMDA(独立行政法人医薬品医療機器総合機構)やFDA(米国食品医薬品局)等の監督官庁との治験申請の事前ミーティング
等を実施し、パイプラインの安全性及び有効性評価のための情報をより効率的に収集できるように努めております。また、臨床試験の実施に当たっては、臨床試験のモニタリングを委託するCRO(受託臨床試験機関)と綿密なコンタクトを取り、常に最新の臨床現場情報を収集するとともに、医学専門家を交えたSRB(安全性評価委員会)を設置する等、臨床試験の安全な実行に対して最大の努力を図っております。さらに、治験保険への加入による損害賠償リスクの移転を図っております。
上記のような対策を行ってはおりますが、予期せぬ副作用による開発の遅滞・中止のリスクを完全に排除することは困難であり、開発の大幅な遅れや開発中止もしくは国内外の監督官庁の承認が得られないといった事態に及んだ場合、当社の事業、財務状況及び業績に影響を与える可能性があります。
③ 法的規制にかかる事項
医薬品の研究開発における薬機法に基づき、医薬品の前臨床試験においてはGLP(Good Laboratory Practice)、原薬等の製造においてはGMP(Good Manufacturing Practice)並びに、臨床試験においてはGCP(Good Clinical Practice)がそれぞれ定められており、その操作手順やQA/QCが確実に実施されていることが必須条件になっております。
当社は遺伝子組換えウイルス製剤を開発しておりますが、日本においては、2000年に生物多様性条約特別締約国会議で採択された「生物の多様性に関する条約のバイオセーフティに関するカルタヘナ議定書(カルタヘナ議定書)」に準拠した国内法「遺伝子組換え生物等の使用等の規制による生物の多様性の確保に関する法律」(カルタヘナ法)の定めるところに従って開発・製造・販売を行っていく必要があります。当社は、国内のウイルス取扱施設において、文部科学大臣より「遺伝子組換え生物等の第二種使用等をする間に執る拡散防止措置の確認」について確認を得るとともに、日本国内でテロメライシンの臨床試験を実施するために、カルタヘナに関する厚生労働大臣の承認を得ております。また、臨床施設では厚生労働省等の監督官庁への届出及び承認を確認しています。
しかしながら、将来医薬品・ウイルス製造等に関する新たな法律や条例などが制定・施行される可能性があり、それにより当社の事業が何らかの制約を受ける可能性があります。その結果、開発の大幅な遅れや開発中止、或いは販売中止といった事態に及んだ場合、当社の事業、財務状況及び業績に影響を与える可能性があります。
④ 技術革新にかかる事項
当社が推進する創薬事業にかかる技術分野においては、いずれも技術革新及び進歩の度合いが著しく速いと考えられます。当社は、常に最新の技術情報の収集・集積に注力しておりますが、万一、医薬品及び検査薬の競合技術等が、当社の対応の及ばない状況下で格段の進歩を遂げた場合、当社の事業に影響を与える可能性があります。また、当該技術の導入等に多大な費用や時間を要する場合、当社の事業、財務状況及び業績に影響を与える可能性があります。
⑤ 競合にかかる事項
当社の業務領域と完全に一致する企業は国内に見当たりませんが、国内創薬系バイオ企業の研究開発の動向を適宜確認するとともに、海外も含めたウイルス製剤の研究・開発・販売の動向は注視しています。
創薬事業の医薬品開発において本書提出日時点で当社にて把握できている競合品としては、世界の多数企業が腫瘍溶解ウイルスの開発を行っている中、中国が最も先行しており、Shanghai Sunway Biotech Co.,Ltd.(中国)が有する当社と同じ増殖型アデノウイルス製剤Oncorineが、頭頸部がん治療薬として既に上市されております。また、遺伝子改変ヘルペスウイルス製剤Talimogene laherpareovec:T-VEC(Amgen社:米国)が、進行性黒色腫治療薬として2015年10月に米国食品医薬品局(FDA)の承認を受けるとともに欧州医薬品庁(EMA)の諮問委員会の承認推奨を受けました。これにより、欧米で初めて、ウイルス製剤が医療現場で使用されることとなりました。日本国内では2021年に第一三共株式会社により、遺伝子改変ヘルペスウイルス「デリタクト注」(一般名:テセルパツレブ)が承認されました。
上記以外に、現在、レオウイルスReolysin(oncolytic Biotechnology社:カナダ)、CG-0070(Cold Genesys社:米国)などが開発されています。当社では開発スピードを早め、他社の腫瘍溶解ウイルスとは異なる適応症を目標とすることで特徴を抽出し、差別化を図って参ります。
しかしながら、これらは未だ臨床開発途中であり、将来、医薬品として上市される保証はなく、臨床試験において、重篤な副作用の発生等で競合品と比して差別化が図れないと判断しうるデータを取得した場合、開発中止の可能性や開発遅延の可能性があります。また、将来、他社とのライセンス契約を締結した場合、ライセンス先の開発戦略の変更や契約解消による開発活動の遅延が生じることで、当社の開発計画及び業績に重大な影響を及ぼす可能性があります。
また、がん検査薬への開発において、当社が対象としている血中循環がん細胞(CTC)の検出分野では、現在Veridex社(J&Jグループ)のCTC検出機器CellSearchシステムが唯一米国にて薬事承認されており、その後多数の企業によるCTC検査系の開発競争が激化しております。しかしながら、CellSearchをはじめとする競合の多くは、EpCAMと呼ばれる細胞表面マーカーを検出する方法を用いており、その細胞表面マーカーの発現が低いと言われている肺がん細胞等の検出が困難であるという欠点を持っております。
一方、当社のウイルス改変検査薬においては、肺がんや膵臓がんをはじめとするほとんどの種類のがんにおいて、血中で生きた状態のがん細胞を蛍光発光させることが可能であることを確認しており、競合品との差別化ができると考えています。
いずれの開発領域におきましても、本書提出日時点、当社が把握する競合の存在及びその研究開発進捗が必ずしも当社にとって直接マイナスの影響をもたらすものではありませんが、競合品が飛躍的に市場を寡占化した場合等、当社のパイプライン導出や将来のロイヤリティ収入に影響を与える可能性があります。
⑥ アライアンスにかかる事項
当社の収益構造は、当社が研究開発する医薬品並びに臨床検査薬について、その研究開発の進捗に伴って評価された製品的価値の初期評価であるProof of Concept(POC)に基づいて製薬企業等とのライセンス契約を締結し、その対価として契約一時金・研究協力金・開発協力金・マイルストーン収入及び製品の上市以降その販売に伴って発生するロイヤリティ収入等を段階的に見込むものであります。
現時点において、Transposon社とLINE-1阻害剤OBP-601(censavudine)の全世界における開発・製造・販売に関する再許諾権付き独占的ライセンス契約を締結しています。また、テロメライシンの日本国内での販売は、富士フイルム富山化学と販売提携契約を締結しています。
導出前の各パイプラインについては、導出先候補となる製薬企業や検査薬企業等のニーズを考慮し、研究開発の進捗状況を効果的に情報提供する等の活動を続けています。しかしながら、当社のパイプラインが導出先候補企業のニーズを満たす保証はなく、導出に至らない、又は導出契約の時期や条件が当社の想定するものと大幅に乖離した場合等において、当社の事業、財務状況及び業績に影響を与える可能性があります。
また、パイプラインを導出した場合、導出後の研究開発・承認申請・製造及び販売活動を導出先企業が行うことになるため、当社の収益は導出先企業の戦略及び開発進捗等に依存することとなります。導出先企業が実施する臨床試験において予期せぬ副作用が発生した場合、及び導出先企業における戦略変更によるポートフォリオの見直し等により、導出済みパイプラインの開発中止等の決定がなされた場合、当社の事業、財務状況及び業績に影響を与える可能性があります。
なお、予期せぬ副作用により開発中止された場合を除き、当社は速やかに引継導出先を見つける活動を行いますが、引継導出先が早期に決定しない場合は、当社の事業、財務状況及び業績に影響を与える可能性があります。
⑦ 為替相場変動リスクにかかる事項
現在、当社の業務委託先及び提携先については、欧米の企業・機関がその大半を占めております。外貨建取引は、財務諸表上全て円換算しております。これらの項目は、現地通貨における価値が変化しなかった場合も、換算時のレートによって円換算後の価値が影響を受ける可能性があります。
為替相場の変動に起因する影響を軽減するために、必要に応じて為替予約などのリスクヘッジを行って参りますが、これによって全てのリスクを回避することは困難であり、当社の事業、財務状況及び業績に影響を与える可能性があります。
(2) 知的財産権について
① 特許にかかる事項
当社は、本書提出日時点において、当社の事業に対する特許権等の知的財産権に関する第三者との間での苦情及び訴訟等といった問題は認識しておりません。さらに、社内に知的財産権の専任担当者を設置するとともに、顧問弁護士及び弁理士との連携を以って可能な限り特許侵害・被侵害のリスクを軽減すべく活動しております。また、発明者、TLO法に基づく大学等の知的財産管理機関、企業及び研究機関から、「特許権又は特許を受ける権利」を正当に譲り受け、又は「実施権の許諾」を受け、事業化が推進できる体制を築いております。
しかし、当社の展開する医薬品・検査薬の一般的なリスクとして、自社で出願した特許以外にも第三者特許が関連する可能性があります。なお、今後、当社が第三者との間で係争に巻き込まれた場合、当社は弁護士や弁理士との協議の上、その内容に応じて対応策を検討していく方針でありますが、係争の解決に労力、時間及び費用を要する可能性があり、その場合、当社の財政状態及び経営成績に影響を及ぼす可能性があります。また、将来的な事業展開においては、他社が保有する特許権等への抵触により、事業上の制約を受けるなど、当社の事業、財務状況及び業績に影響を与える可能性があります。
主力パイプラインにかかる主要な特許の状況は以下のとおりです。
対象 | 適応症 | 特許権者 又は出願人 | 当社 | 備考 |
テロメライシン (OBP-301) | 固形がん(食道がんなど) | 当社 | 特許権者 | 日本で耐性腫瘍への投与に関する特許が成立。 |
Stabilitech Biopharma Limited | 世界における独占的実施権 | 日本・米国・欧州を含む24カ国でウイルス保存安定製剤に関する特許が成立。 |
OBP-601 (censavudine) | PSP(進行性核上性麻痺)、ALS(筋萎縮性側索硬化症)、FTD(前頭側頭型認知症)、AGS(アイカルディ・ゴーティエ症候群) | Yale University
他 | 世界における独占的実施権 | 日本・米国・欧州を含む16カ国で物質に関する特許が成立。 |
OBP-801 | 眼科領域 | 当社、京都府公立大学法人 | 出願人 | 日本で眼科領域への用途に関する特許を出願中。 |
テロメスキャン (OBP-401) | がんの体外検査 | 当社 | 特許権者 | 日本及び欧州を含む10カ国で物質に関する特許が成立。 |
テロメスキャンF35 (OBP-1101) | がんの体外検査 | 国立研究開発法人 医薬基盤・健康・栄養研究所 | 世界における独占的実施権 | 日本・米国・欧州を含む13カ国で物質に関する特許が成立。さらにテロメスキャン(OBP-401)の項目に記載の特許によっても保護される。 |
OBP-2011 | ウイルス感染症 | 当社 | 出願人 | 物質に関する特許を国際(PCT)出願中。新型コロナウイルス感染症治療薬用途に関する特許を日本・米国・欧州に出願中。(計2件) |
② 職務発明にかかる事項
当社における職務発明の取扱に関しては、取締役・従業員が協議の上、取締役会決議により「職務発明規程」を作成し、運用しております。しかしながら、将来、発明者の認定及び職務発明の対価の相当性についての係争が発生した場合、当社の事業、財務状況及び業績に影響を与える可能性があります。


 読み込み中です...
読み込み中です... 読み込み中です...
読み込み中です...





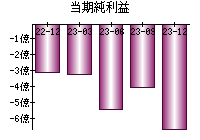
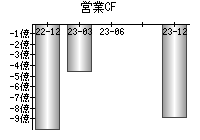
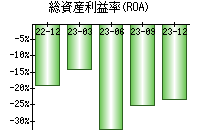
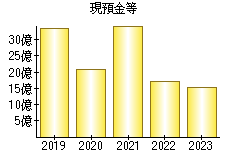

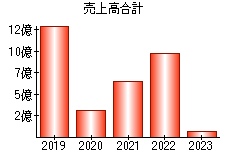



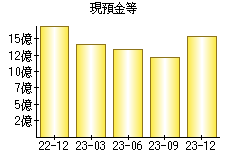
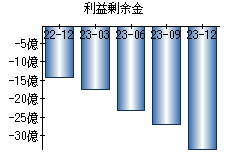
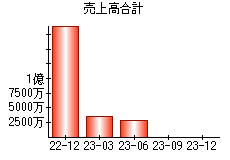
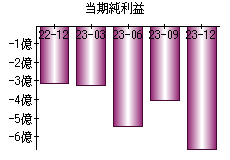

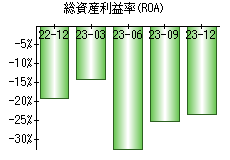
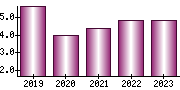
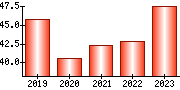








就職・転職をするときに最低限チェックしておきたい項目をまとめました。
ユーレットは就職活動・転職活動中の皆さまを応援しています。