当社グループは、3ADC(トラスツズマブ デルクステカン:T-DXd/DS-8201、ダトポタマブ デルクステカン:Dato-DXd/DS-1062、パトリツマブ デルクステカン:HER3-DXd/U3-1402)の製品価値最大化を目指してリソースを集中投入するとともに、持続的成長の実現に向けてSOC(注1)を変革する製品群(Alpha)の創薬を目指す「3 and Alpha」戦略のもと、外部との積極的な協業も含め、研究開発に取り組んでおります。また、グローバル臨床開発の加速化にも注力しております。
中長期的には、がんに加え、当社のサイエンス&テクノロジーの優位性を活かして様々な疾患に対する治療薬創製を目指し、新規モダリティ(注2)の技術研究等を通じた創薬力の強化に取り組んでおります。
(注)1.Standard of Careの略。現在の医学では最善とされ、広く用いられている治療法。
2.ADC、核酸医薬、治療用ウイルス、細胞治療等の新規治療手段。
当連結会計年度の研究開発費(IFRSベース)は、3,416億円(前連結会計年度比31.2%増)となり、売上収益に対する研究開発費の比率は、26.7%となりました。
(1) 3ADC
当連結会計年度における3ADCの臨床開発の状況は次のとおりであります。
① トラスツズマブ デルクステカン(T-DXd/DS-8201:抗HER2 ADC、製品名:エンハーツ)
製品名エンハーツとして販売しております。がん領域のグローバル事業において豊富な経験を持つアストラゼネカと本剤を共同で開発しております。
当連結会計年度における主な進捗は次のとおりであります。
・2022年4月、HER2遺伝子変異を有する非小細胞肺がんの2次治療を対象とした米国における承認申請を受理いたしました。
・2022年4月、HER2低発現乳がん(化学療法既治療)を対象とした米国食品医薬品局(FDA)からの画期的治療薬(注3)の指定を獲得いたしました。
・2022年5月、HER2陽性乳がんの2次治療を対象とした米国における承認を取得いたしました。
・2022年6月、米国臨床腫瘍学会(ASCO)におけるHER2低発現乳がん(化学療法既治療)を対象としたフェーズ3試験(試験名:DESTINY-Breast04)の最新データを発表いたしました。
・2022年6月、HER2低発現乳がん(化学療法既治療)を対象とした国内と欧州における承認申請を受理いたしました。
・2022年6月、HER2陽性乳がんの2次治療を対象とした欧州医薬品局(EMA)の医薬品委員会(CHMP)による承認の勧告を受領いたしました。
・2022年7月、HER2陽性乳がんの2次治療を対象とした欧州における承認を取得いたしました。
・2022年7月、HER2低発現乳がん(化学療法既治療)を対象とした米国における承認申請を受理いたしました。8月、同適応を対象とした米国における承認を取得いたしました。
・2022年8月、HER2遺伝子変異を有する非小細胞肺がんの2次治療を対象とした米国における承認を取得いたしました。
・2022年8月、HER2陽性乳がんの3次治療を対象としたフェーズ3試験(試験名:DESTINY-Breast02)における主要評価項目を達成いたしました。
・2022年8月、HER2遺伝子変異を有する非小細胞肺がんの2次治療以降を対象とした中国におけるフェーズ2試験(試験名:DESTINY-Lung05)を開始いたしました。
・2022年9月、欧州臨床腫瘍学会(ESMO)における非小細胞肺がんを対象としたフェーズ2試験(試験名:DESTINY-Lung01、DESTINY-Lung02)のデータを発表いたしました。
・2022年9月、HER2遺伝子変異陽性の切除不能な進行・再発の非小細胞肺がんを対象とした厚生労働省からの希少疾病用医薬品(注4)の指定を獲得いたしました。
・2022年11月、HER2陽性胃がんの2次治療を対象としたEMAのCHMPによる承認の勧告を受領いたしました。
・2022年11月、HER2陽性乳がんの2次治療を対象とした国内における承認を取得いたしました。
・2022年12月、サンアントニオ乳がんシンポジウム(SABCS)におけるHER2陽性乳がんの2次治療を対象としたフェーズ3試験(試験名:DESTINY-Breast03)の最新データ及び3次治療を対象としたフェーズ3試験(試験名:DESTINY-Breast02)の初のデータを発表いたしました。
・2022年12月、HER2遺伝子変異を有する非小細胞肺がんの2次治療を対象とした国内における承認を申請いたしました。
・2022年12月、HER2低発現乳がん(化学療法既治療)を対象としたEMAのCHMPによる承認の勧告を受領いたしました。
・2022年12月、HER2陽性胃がんの2次治療を対象とした欧州における承認を取得いたしました。
・2023年1月、HER2遺伝子変異を有する非小細胞肺がんの2次治療を対象とした欧州における承認申請を受理いたしました。
・2023年1月、HER2低発現乳がん(化学療法既治療)を対象とした欧州における承認を取得いたしました。
・2023年2月、HER2陽性乳がんの2次治療を対象とした中国における承認を取得いたしました。
・2023年3月、HER2発現の複数の固形がん患者を対象としたフェーズ2試験(試験名:DESTINY-PanTumor02)の中間解析における所期の目標を達成いたしました。
・2023年3月、HER2低発現乳がん(化学療法既治療)を対象とした国内における承認を取得いたしました。
(注)3.重篤な疾患を対象に、既存の治療薬よりも高い治療効果を示す可能性のある薬剤の開発と審査を促進し、患者により早く新薬を届けるために定められた制度。
4.国内における患者数が5万人未満であり、医療上特にその必要性が高いものなどの条件に合致するものとして、開発の支援・促進を目的として指定される制度。
② ダトポタマブ デルクステカン(Dato-DXd/DS-1062:抗TROP2 ADC)
がん領域のグローバル事業において豊富な経験を持つアストラゼネカと本剤を共同で開発しております。
当連結会計年度における主な進捗は次のとおりであります。
・2022年6月、トリプルネガティブ乳がんの1次治療を対象としたフェーズ3試験(試験名:TROPION-Breast02)を開始いたしました。
・2022年7月、非小細胞肺がん及びトリプルネガティブ乳がんを対象とした中国におけるフェーズ1/2試験(試験名:TROPION-PanTumor02)を開始いたしました。
・2022年8月、世界肺がん学会(WCLC)における非小細胞肺がんを対象とした免疫チェックポイント阻害剤との併用療法のフェーズ1b試験(試験名:TROPION-Lung02)の初のデータを発表いたしました。
・2022年9月、複数の固形がんを対象としたフェーズ2試験(試験名:TROPION-PanTumor03)を開始いたしました。
・2022年12月、SABCSにおけるホルモン受容体陽性かつHER2低発現又は陰性の転移性乳がんを対象としたフェーズ1試験(試験名:TROPION-PanTumor01)の初のデータを発表いたしました。
・2022年12月、SABCSにおけるトリプルネガティブ乳がんを対象とした単剤療法のフェーズ1試験(試験名:TROPION-PanTumor01)及び免疫チェックポイント阻害剤との併用療法のフェーズ1/2試験(試験名:BEGONIA)の最新データを発表いたしました。
・2022年12月、トリプルネガティブ乳がんの術前薬物療法後の治療を対象とした単剤療法及びデュルバルマブ併用療法のフェーズ3試験(試験名:TROPION-Breast03)を開始いたしました。
・2023年1月、アクショナブル遺伝子変異がなくPD-L1の発現率が50%未満の非小細胞肺がんの1次治療を対象とした、免疫チェックポイント阻害剤との併用療法のフェーズ3試験(試験名:TROPION-Lung07)を開始いたしました。
③ パトリツマブ デルクステカン(HER3-DXd/U3-1402:抗HER3 ADC)
当連結会計年度における主な進捗は次のとおりであります。
・2022年6月、ASCOにおける乳がんを対象としたフェーズ1/2試験及び非小細胞肺がんを対象としたフェーズ1試験の最新データを発表いたしました。
・2022年8月、EGFR遺伝子変異を有する非小細胞肺がんの2次治療を対象としたフェーズ3試験(試験名:HERTHENA-Lung02)を開始いたしました。
・2023年3月、日本臨床腫瘍学会(JSMO)における転移性非小細胞肺がん患者を対象としたグローバルフェーズ1試験及びHER3発現を有する転移性乳がん患者を対象とした日米フェーズ1/2試験の最新データを発表いたしました。
(2) Alpha
当連結会計年度におけるAlphaの臨床開発の主な進捗は次のとおりであります。
・2022年6月、ASCOにおけるDS-6000(抗CDH6 ADC)の卵巣がん及び腎細胞がんを対象としたフェーズ1試験の最新データを発表いたしました。
・2022年6月、欧州血液学会議(EHA)におけるキザルチニブ(AC220:FLT3阻害剤、国内製品名:ヴァンフリタ)の急性骨髄性白血病(AML)の1次治療を対象としたフェーズ3試験(試験名:QuANTUM-First)の最新データを発表いたしました。
・2022年6月、DS-2325(KLK5阻害剤)の健康成人を対象としたフェーズ1試験を開始いたしました。
・2022年6月、DS-7300(抗B7-H3 ADC)の小細胞肺がんの2次治療を対象としたフェーズ2試験を開始いたしました。
・2022年6月、DS-9606(ターゲット非開示 ADC)の固形がんを対象としたフェーズ1試験を開始いたしました。
・2022年8月、キザルチニブのAMLの1次治療を対象とした国内及び欧州における承認申請を受理いたしました。
・2022年9月、ESMOにおけるDS-7300の固形がんを対象としたフェーズ1/2試験の最新データを発表いたしました。
・2022年9月、バレメトスタット(DS-3201:EZH1/2阻害剤、製品名:エザルミア)の再発又は難治性の成人T細胞白血病リンパ腫(ATLL)を対象とした国内における承認を取得いたしました。
・2022年10月、キザルチニブのAMLの1次治療を対象とした米国における承認申請を受理いたしました。
・2022年11月、DS-1211(TNAP阻害剤)の弾性線維性仮性黄色腫(PXE)患者を対象としたフェーズ2試験を開始いたしました。
・2022年12月、アキシカブタゲン シロルユーセル(Axi-Cel:抗CD19 CAR-T細胞、国内製品名:イエスカルタ)の再発又は難治性の大細胞型B細胞リンパ腫の2次治療を対象とした国内における承認を取得いたしました(注5)。
・2022年12月、DS-2325(KLK5阻害剤)のネザートン症候群を対象としたFDAからの希少疾病用医薬品(注6)の指定及び2023年2月、FDAからのファストトラック(注7)の指定を獲得いたしました。
・2023年3月、経鼻弱毒性インフルエンザワクチン(VN-0107、製品名:フルミスト)の国内における承認を取得いたしました。
(注)5.2022年12月、当社、Kite Pharma, Inc.及びギリアド・サイエンシズ株式会社は、当社の保有するイエスカルタの国内製造販売承認を2023年中にギリアド・サイエンシズ株式会社へ承継することに合意いたしました。
6.米国における患者数20万人未満の希少疾病に対する治療、診断、予防を目的とした医薬品を対象として指定され、税制優遇、助成金等の優遇措置を受けることができる制度。
7.重篤で未充足の医療ニーズが高い疾患に対し、高い治療効果が期待できる薬剤の開発・審査の迅速化を目的とした米国における制度。
(3) 新型コロナウイルス感染症(COVID-19)への取り組み
当社グループは、社会的に課題となっている国内での新型コロナウイルス感染症(COVID-19)(以下「COVID-19」という。)に対するワクチン生産体制の確立に向けて積極的に取り組んでおります。当社の持つ研究財産、技術及び知識を最大限に活用し、外部機関とも連携して、以下の研究開発を推進しております。
DS-5670(COVID-19 mRNAワクチン)
DS-5670は、当社が独自に見出したカチオン性脂質を用いたCOVID-19に対するmRNAワクチンであります。ワクチン未接種健康成人を対象とした初回免疫並びに国内既承認mRNAワクチンを2回接種済みで、接種から6ヶ月以上経過した健康成人及び高齢者を対象とした追加免疫を確認する臨床試験を実施しております。なお、DS-5670の研究開発は、国立研究開発法人日本医療研究開発機構(AMED)の「ワクチン開発推進事業」及び厚生労働省の「ワクチン生産体制等緊急整備事業(注8)」の支援を受けて実施しております
(注)8.COVID-19をはじめとした予期せぬ感染症の流行阻止・重症化予防に必要なワクチンを可能な限り迅速に製造し、日本国民のために確保するため、ワクチンを含むバイオ医薬品の実生産(大規模生産)体制を早期構築することを目的とした事業。
当連結会計年度における主な進捗は次のとおりであります。
・2022年5月、ワクチン未接種健康成人を対象とした起源株ワクチンのフェーズ2試験の試験結果を入手いたしました。
・2022年5月、追加免疫投与によるブースター効果を確認する起源株ワクチンのフェーズ1/2/3試験において、健康成人及び高齢者を対象とした国内既承認mRNAワクチンを用いた実薬対照非劣性試験を開始いたしました。
・2022年9月、ワクチン未接種健康成人を対象とした起源株ワクチンのフェーズ3試験を開始いたしました。
・2022年11月、追加免疫投与によるブースター効果を確認する起源株ワクチンのフェーズ1/2/3試験における主要評価項目を達成いたしました。
・2022年11月、ワクチン未接種の12~17歳の健康小児を対象とした起源株ワクチンのフェーズ3試験を開始いたしました。
・2023年1月、起源株ワクチンの健康成人及び高齢者を対象とした追加免疫投与に係る承認を申請いたしました。

 最新の情報を確認しています...
最新の情報を確認しています... 読み込み中です...
読み込み中です... 読み込み中です...
読み込み中です...





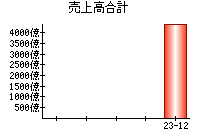
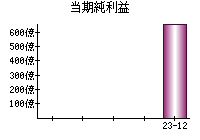
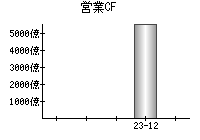
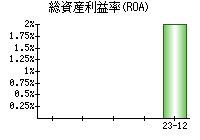
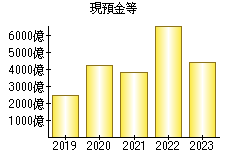
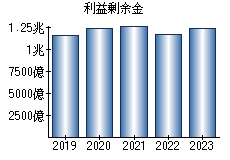
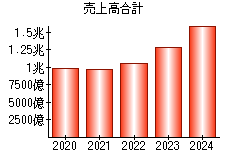
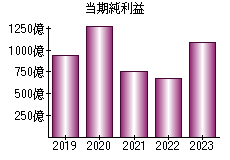
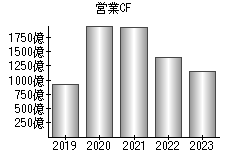
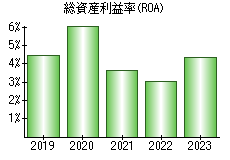
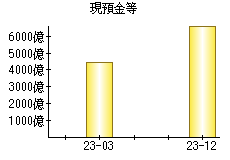
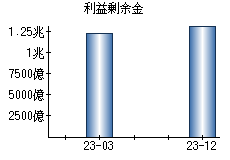
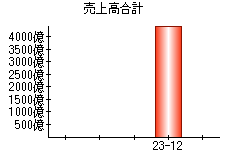
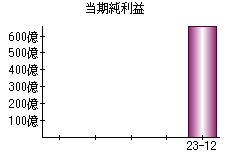
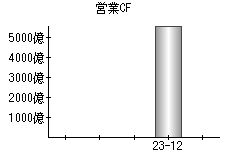
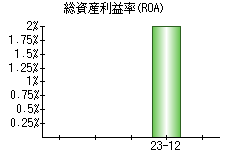
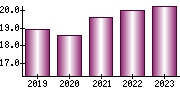
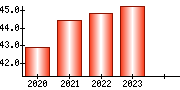
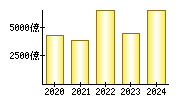
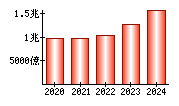







就職・転職をするときに最低限チェックしておきたい項目をまとめました。
ユーレットは就職活動・転職活動中の皆さまを応援しています。