当社は、2021年5月に発表した経営計画2021において、「患者さんのより良いアウトカムの実現」「科学の進歩を確かな『価値』へ」「Rx+ビジネスの進展」「サステナビリティ向上の取り組みを強化」の4つを戦略目標として掲げ、「価値」 (注) の創造と提供の実現を目指しています。経営計画2021及び各戦略目標については、「第2 事業の状況 1 経営方針、経営環境及び対処すべき課題等 (2) 対処すべき課題」に記載しています。
(注) 患者さんにとって真に重要なアウトカム(治療等による臨床上の成果)を、それを提供するためにヘルスケアシステムが負担するコストで除したもの
当連結会計年度における研究開発活動をはじめとする持続的な成長に向けた主な取り組みは以下のとおりです。
(1) 戦略目標1:患者さんのより良いアウトカムの実現
前立腺がん治療剤XTANDI/イクスタンジ及び中長期にわたり成長を支える重点戦略製品 (注) に優先的に経営資源を振り向けました。上市済の製品については、尿路上皮がん治療剤パドセブや急性骨髄性白血病治療剤ゾスパタ、腎性貧血治療剤エベレンゾ等、当社の成長をけん引する製品の育成と製品価値の最大化を図りました。開発後期段階においては、fezolinetantの米国及び欧州における承認申請、ゾルベツキシマブの2つの第Ⅲ相試験における主要評価項目達成等、多くの進展がありました。
(注) パドセブ、ゾスパタ、ゾルベツキシマブ、エベレンゾ、fezolinetant、AT132
当連結会計年度におけるXTANDI及び重点戦略製品の売上及び主な進捗状況は以下のとおりです。
・前立腺がん治療剤XTANDI/イクスタンジ(一般名:エンザルタミド)
当連結会計年度売上:6,611億円 (前連結会計年度比23.7%増)
全ての地域で売上が拡大し、グローバル売上は前連結会計年度と比較して増加しました。特にエスタブリッシュドマーケット、日本及びインターナショナルマーケットにおいて処方が伸長し、売上の拡大に貢献しました。追加適応症の開発の主な進捗状況は以下のとおりです。
2023年3月 転移性ホルモン感受性前立腺がん患者を対象とした第Ⅲ相China ARCHES試験において、主要評価項目 (前立腺特異抗原増悪までの期間) を達成したことを公表しました。
2023年3月 非転移性ホルモン感受性前立腺がん患者を対象とした第Ⅲ相EMBARK試験において、主要評価項目 (無転移生存期間) を達成したことを公表しました。
・尿路上皮がん治療剤パドセブ(一般名:エンホルツマブ ベドチン)
当連結会計年度売上:444億円 (前連結会計年度比104.4%増)
米国において、これまでに承認を取得した適応症の患者層に対する推奨治療オプションとしてのポジショニングを確立したことにより、売上が増加しました。日本においても、推奨治療オプションとしての浸透が進み、新規患者数が大きく増加し、売上が増加しました。また、欧州においては、2022年4月の承認以降、発売国が着実に拡大し、売上の増加に貢献しました。追加適応症の承認取得及び開発の進捗状況は以下のとおりです。
2022年4月 欧州において、白金製剤を含む化学療法及びPD-1又はPD-L1阻害剤による治療歴のある局所進行性又は転移性尿路上皮がん患者における単剤療法に関し、販売承認を取得しました。
2023年3月 中国において、PD-1又はPD-L1阻害剤及び白金製剤を含む化学療法による治療歴のある局所進行性又は転移性尿路上皮がん患者を対象として、第Ⅱ相EV-203試験の結果に基づいた生物学的製剤承認申請が受理されました。
2023年4月 米国において、本剤とMerck社 (米国) のPD-1阻害剤KEYTRUDA (一般名:ペムブロリズマブ) との併用療法について、局所進行性又は転移性尿路上皮がんでシスプラチン不適応の患者における一次治療に関し、迅速承認を取得しました。
・急性骨髄性白血病治療剤ゾスパタ(一般名:ギルテリチニブフマル酸塩)
当連結会計年度売上:466億円 (前連結会計年度比36.7%増)
高いマーケットシェアを獲得している米国や欧州、日本での継続的な成長に加えインターナショナルマーケットでは発売国が増加するなど、全ての地域で売上が増加しました。追加適応症に関する開発の進捗状況は以下のとおりです。
2023年3月 FLT3遺伝子変異陽性急性骨髄性白血病患者における造血幹細胞移植後の維持療法を対象とした第Ⅲ相MORPHO試験に関し、主要評価項目 (無再発生存期間) を達成しなかったことを公表しました。
・腎性貧血治療剤エベレンゾ(一般名:ロキサデュスタット)
当連結会計年度売上:32億円 (前連結会計年度比23.0%増)
欧州においては発売国が増加したことに伴い売上が拡大した一方、日本では市場の競合激化の影響を受け売上が減少しました。開発の進捗状況は以下のとおりです。
2022年10月 化学療法に伴う貧血を対象として臨床第Ⅱ相段階にあった開発を当社の権利範囲において中止したことを公表しました。
その他の重点戦略製品に関する開発の主な進捗状況は以下のとおりです。
・選択的ニューロキニン3受容体拮抗薬fezolinetant(一般名)
2022年8月 米国において、閉経に伴う中等度から重度の血管運動神経症状を有する女性を対象とした販売承認申請が受理されました。審査終了目標日は2023年2月22日と定められました。
2022年9月 閉経に伴う血管運動神経症状を有するアジア在住女性を対象とした第Ⅲ相MOONLIGHT3試験において、長期安全性を裏付ける52週データが得られたことを公表しました。
2022年9月 欧州において、閉経に伴う中等度から重度の血管運動神経症状を有する女性を対象とした販売承認申請が受理されました。
2023年2月 米国食品医薬品局から、審査終了目標日を延長する旨の通知を受領しました。新たな審査終了目標日は2023年5月22日と定められました。
・抗Claudin 18.2モノクローナル抗体ゾルベツキシマブ(一般名)
2022年11月 胃腺がん及び食道胃接合部腺がんを対象とした第Ⅲ相SPOTLIGHT試験に関し、主要評価項目 (無増悪生存期間) を達成したことを公表しました。
2022年12月 胃腺がん及び食道胃接合部腺がんを対象とした第Ⅲ相GLOW試験に関し、主要評価項目 (無増悪生存期間) を達成したことを公表しました。
・X連鎖性ミオチュブラーミオパチー (XLMTM) 患者を対象とする遺伝子治療薬AT132 (一般名:resamirigene bilparvovec)
2021年9月に米国食品医薬品局から発出された臨床試験差し止め通知の解除に向け、当局と協議を行っています。
また、その他の主要製品の売上は以下のとおりです。
・過活動膀胱 (OAB) 治療剤ベタニス/ミラベトリック/ベットミガ (一般名:ミラベグロン)
当連結会計年度売上:1,886億円 (前連結会計年度比9.5%増)
地域ごとに増減はあったものの、グローバルの売上は拡大しました。
・免疫抑制剤プログラフ (一般名:タクロリムス水和物)
当連結会計年度売上:1,988億円 (前連結会計年度比7.2%増)
グローバルの売上は増加しました。
上記以外に、医療用医薬品事業に関する以下の取り組みを行いました。
2023年1月 キャンディン系抗真菌剤ファンガード (一般名:ミカファンギンナトリウム) に関し、日本を含む全世界での製造販売承認をSandoz社 (スイス) に譲渡する資産譲渡契約を締結しました。
(2) 戦略目標2:科学の進歩を確かな「価値」へ
当社は、Focus Areaアプローチという研究開発戦略の下、多面的な視点で創薬ターゲットを絞り込む新しいアプローチで革新的な製品の創出に取り組んでいます。2023年3月現在、Focus Areaのうち重点的に研究開発投資を行うPrimary Focus (注) として「遺伝子治療」「がん免疫」「再生と視力の維持・回復」「ミトコンドリア」「標的タンパク質分解誘導」の5つを認定しています。
(注) Focus Areaの中における特定の組合せで、科学的妥当性、研究開発や商業化の実現可能性、プロジェクトの充実度や進捗等の観点から選択され、優先的な投資対象となるもの
当連結会計年度における各Primary Focusの主な進展は以下のとおりです。
・Primary Focus 遺伝子治療
2022年10月 Taysha Gene Therapies社 (米国) との間で、アデノ随伴ウイルス (AAV) を活用した遺伝子治療プログラムに関する戦略的提携についての契約を締結しました。
2023年1月 Selecta Biosciences社 (米国) との間で、遅発型ポンペ病患者を対象とする遺伝子治療薬AT845と併用する候補として、次世代免疫グロブリンGプロテアーゼIdeXorkの独占的ライセンス及び開発に関する契約を締結しました。
2023年1月 遺伝子治療薬AT845の第Ⅰ/Ⅱ相FORTIS試験に関して、2022年6月に米国食品医薬品局から受領していた臨床試験差し止め指示が解除されました。
・Primary Focus がん免疫
2022年5月 GO Therapeutics社 (米国) との間で、がん免疫療法の新規抗体開発に向けた戦略的共同研究及びライセンス契約を締結しました。
2022年6月 Sutro Biopharma社 (米国) との間で、抗体-薬物複合免疫賦活薬の共同研究・開発に関する全世界における戦略的提携及びライセンスに関する契約を締結しました。
2022年6月 抗Claudin 18.2/抗CD3二重特異性抗体ASP2138について、胃腺がん及び食道胃接合部腺がん、膵臓腺がん患者を対象とする第Ⅰ相試験の最初の症例への投与を達成しました。
2023年3月 二重特異性抗体ASP2074について、がん患者を対象とする第Ⅰ相試験の最初の症例への投与を達成しました。
2023年3月 二重特異性抗体ASP1002について、がん患者を対象とする第Ⅰ相試験の最初の症例への投与を達成しました。
2023年4月 がんを対象として第Ⅰ相段階にあった腫瘍溶解性ウイルスASP9801の開発を中止したことを公表しました。
2023年4月 急性骨髄性白血病及び骨髄異形成症候群を対象として第Ⅱ相段階に、固形がんを対象として第Ⅰ相段階にあった人工アジュバントベクター細胞ASP7517の開発を中止したことを公表しました。
2023年4月 がんを対象として第Ⅰ相段階にあった人工アジュバントベクター細胞ASP0739の開発を中止したことを公表しました。
・Primary Focus 再生と視力の維持・回復
2022年8月 地図状萎縮を伴う加齢黄斑変性患者を対象とする細胞医療ASP7317の第Ⅰb相試験における症例スクリーニングを再開しました。
・Primary Focus ミトコンドリア
2023年4月 鎌状赤血球症を対象として第Ⅰ相段階にあったBACH1阻害薬ASP8731/ML-0207の開発を中止したことを公表しました。
・Primary Focus 標的タンパク質分解誘導
2022年6月 KRAS G12D分解誘導薬ASP3082について、がん患者を対象とする第Ⅰ相試験の最初の症例への投与を達成しました。
2023年2月 ASP3082に関し、KRAS G12D変異を有する膵臓腺がん患者を対象とする開発について、米国食品医薬品局からファストトラック指定を取得しました。
当連結会計年度におけるPrimary Focus以外の研究開発活動の主な進展は以下のとおりです。
2022年4月 国立大学法人 東京大学との間で、革新的な新薬や医療ソリューションの創出を目指し連携協力する戦略的パートナーシップを開始しました。
2022年6月 Mogrify社 (英国) との間で、感音難聴の治療薬創出を目指した再生医療に関する共同研究契約を締結しました。
2022年7月 米国カリフォルニア州に、最先端の研究所やオフィススペース等を備えたバイオテクノロジー拠点を新設することを公表しました。
2022年8月 JAK阻害剤ペフィシチニブ (一般名) に関し、関節リウマチを適応症として、中国において承認申請を行いました。
2022年8月 GABAB受容体陽性アロステリック修飾物質ASP8062について、オピオイド使用障害を対象として臨床第Ⅱ相段階にあった開発を中止したことを公表しました。
2022年10月 Pantherna Therapeutics社 (ドイツ) との間で、mRNAを用いたダイレクトリプログラミングによる革新的な再生医療プログラムの創出を目指して、技術検証研究に関する新たな契約を締結しました。
2023年4月 感音難聴を対象として第Ⅱ相段階にあったFX-322の開発を中止したことを公表しました。
(3) 戦略目標3:Rx+ビジネスの進展
当社は、医療用医薬品 (Rx) に留まらず、ペイシェントジャーニー (診断、予防、治療及び予後管理を含む医療シーン) 全体において、様々な方法で患者さんに「価値」を届けることを目指しています。私たちはこの取り組みをRx+事業と呼んでいます。「科学的根拠に基づくヘルスケアソリューションによって、心身ともに健康に、自分らしく生きることができる社会」の実現を目指し、Rx+プログラムの事業化に鋭意取り組んでいます。
当連結会計年度における主な進展は以下のとおりです。
・精密手術をガイドする蛍光造影剤
2022年9月 蛍光造影剤ASP5354 (一般名:pudexacianinium chloride) について、リンパ節マッピングを実施する乳がん及びメラノーマ患者でのリンパ節の可視化・同定を対象とする第Ⅱ相試験の最初の症例への投与を達成しました。
・心疾患患者サポートエコシステム
2022年6月 日東電工株式会社及び株式会社エムハートとの間で締結した、使い切りホルター心電計「EG HolterTM」のパイロット販売に関する契約に基づき、電子商取引サイトを通じてパイロット販売を開始しました。
・慢性疾患の重症化予防
2022年10月 Tribered社 (フィンランド) が開発したスマートフォン向けゲームアプリ「ムーミンムーブ」を通じた歩行習慣や行動に関するデータを取得・解析することについて、北海道及び青森県とそれぞれ提携しました。
2022年10月 株式会社バンダイナムコエンターテインメントと共同開発していた運動支援ゲームアプリについて、開発を中止したことを公表しました。
・埋め込み型医療機器
当社の完全子会社であるアイオタ・バイオサイエンシズ社において、2023年度の臨床試験開始を目標として前臨床試験を行っています。
・モバイルヘルスケアソリューション
2023年3月 ロシュDCジャパン株式会社との間で、同社の血糖自己測定器と、当社がWelldoc社 (米国) と共同で日本において製品化を進めている糖尿病治療支援プログラムBlueStarを、組合せ医療機器 (注) として日本で開発・商業化するための契約を締結したことを公表しました。
(注) 診断や治療などに必要な医療機器を組み合わせた状態で、薬事手続がなされているもの
(4) 戦略目標4:サステナビリティ向上の取り組みを強化
・サステナビリティ方針の策定
2021年度、マテリアリティ・マトリックスの改定により当社と社会の双方にとっての19の重要課題を選定し、そのうち9つを最重要課題 (マテリアリティ) として特定しました。2022年度は、9つの最重要課題をサステナビリティ向上のための2つの柱としてまとめ、さらに、社会からの要請の高い環境に関して2つの重要課題を加えて、サステナビリティ方針を策定しました。サステナビリティ方針では、当社の2025年度までの中期の優先項目と具体的な取り組みを設定しています。
![]()
・サステナビリティ向上の取り組み
当連結会計年度における代表的なサステナビリティ向上の取り組みとその結果は、「第2 事業の状況 2 サステナビリティに関する考え方及び取組」に記載のとおりです。
なお、当連結会計年度の研究開発費は2,761億円(前連結会計年度比12.2%増)、売上収益研究開発費比率は18.2%となりました。
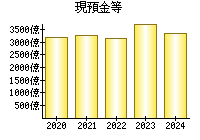
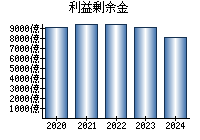
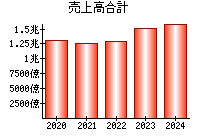
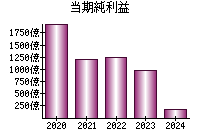
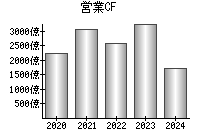
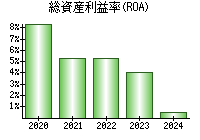
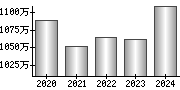
 最新の情報を確認しています...
最新の情報を確認しています... 最新の情報を確認しています...
最新の情報を確認しています...


 最新の情報を確認しています...
最新の情報を確認しています...





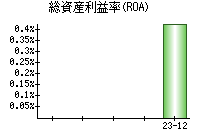
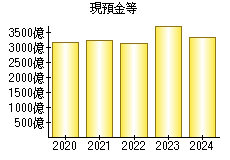
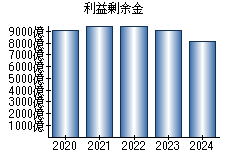
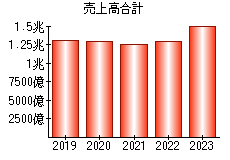
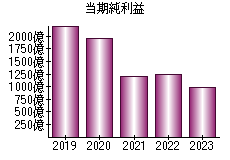
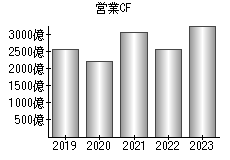
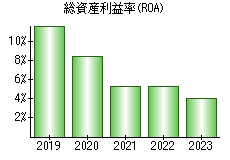
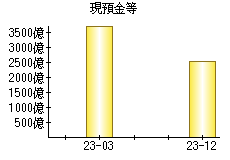
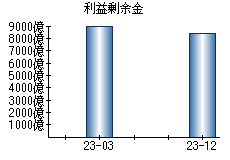
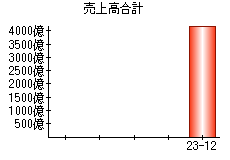
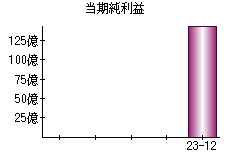
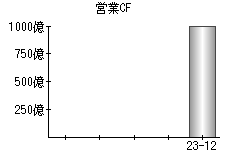
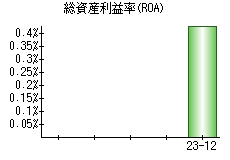
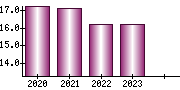
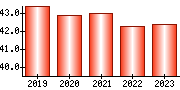
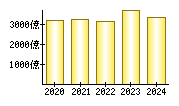







就職・転職をするときに最低限チェックしておきたい項目をまとめました。
ユーレットは就職活動・転職活動中の皆さまを応援しています。